伴侣动物粪便微生物群移植(FMT)联盟(The Companion Animal Fecal Microbiota Transplantation (FMT) Consortium)是一个国际兽医专家小组,目前在犬猫中开展粪便微生物群移植。基于现有的证据和专家意见,伴侣动物FMT联盟制定了首个伴侣动物FMT临床指南,旨在提高FMT作为犬猫微生物导向疗法的可及性。这份临床指南包括粪便供体筛选、FMT 产品加工和制备以及当前 FMT 临床适应症和给药的建议和方案,可供兽医师在临床实践中使用。

关键词
● 粪便微生物群移植 ● 粪便移植 ● 生态失调 ● 微生物导向疗法 ● 伴侣动物 ● 微生物组 ● 微生物群 ● 临床指南
要点
粪便微生物群移植(FMT)是将健康供体的粪便转移至患病受体,以直接改善受体肠道微生物生态系统,为受体带来健康益处。
FMT 是一种安全、耐受性良好且微创的操作,可在任何兽医实践类型中进行。
兽医可建立粪便供体计划,供体筛选指南可以根据具体病例情况进行修改。
应尽可能使用新鲜粪便用于FMT;FMT产品加工和制备的具体建议可以根据每个诊所的人员和设备资源情况进行调整。
目前在兽医学领域,伴侣动物FMT联盟推荐将FMT作为犬细小病毒性肠炎、犬急性腹泻以及犬猫慢性肠病的一种辅助性微生物导向疗法。
引言
越来越多的证据表明,调节肠道微生物群对治疗疾病和维持健康至关重要。FMT 利用供体粪便改变受体肠道微生物生态系统,从而为患有肠道生态失调的患者带来健康益处。对 FMT 实用性的研究在传染病[1]、胃肠病[2]、内分泌学[3]、神经病学[4]和肿瘤学[5]等多个领域日益增多。FMT 治疗复发性艰难梭菌(Clostridioides difficile)感染代表了直接调节肠道微生物生态系统以恢复健康的第一个成功的人类临床应用[6]。
目前在兽医学中,围绕 FMT 的微生物组研究尚处于起步阶段[7,8]。在伴侣动物中,与肠道微生物群落纵向变化、微生物定植、宿主-微生物相互作用、FMT 剂量和给药途径相关的机制研究有限。伴侣动物信息的匮乏表明,需要进一步研究肠道微生物及其代谢在疾病状态中的作用,以及像 FMT 这样的微生物导向疗法如何在临床上应用。
伴侣动物 FMT 联盟,一个独特的国际兽医专家团体,成立的目的是为伴侣动物制定首个临床 FMT 指南。该联盟旨在通过简化并阐明在临床实践中进行 FMT 的过程,提高 FMT 作为一种微生物导向疗法在犬猫中的可及性。后续讨论中呈现的信息旨在总结 FMT 的技术方面、当前小动物 FMT 的治疗适应症以及建立粪便供体计划的重要考虑因素。这些 FMT 临床指南供各种临床实践类型的兽医使用,并可根据个体从业者可用的财政和技术资源进行必要的修改和调整。
临床指南的制定过程
伴侣动物 FMT 联盟旨在为犬猫制定首个兽医临床 FMT 指南,以便在各种临床实践中为兽医进行FMT提供循证建议。与人类FMT临床实践共识声明所采用的方法一致[9],完成了以下步骤:选择专家加入伴侣动物FMT联盟;确定临床指南的主要主题并组建工作组;制定与主题相关的声明,并对现有证据进行严格评估;通过电子改良德尔菲法(Delphi)就临床声明达成共识[10],以及召开虚拟会议以制定临床声明的最终版本。
伴侣动物FMT联盟的成员是根据他们在犬猫粪便微生物移植方面的专业知识选出的,代表了来自学术界和私人诊所的不同背景。FMT联盟由来自 19 个机构的 21 位全球专家组成,每位成员都在本文所呈现的临床FMT指南的制定中发挥着积极作用。根据每位成员的专业知识,他们被分配到以下工作组中:(1)供体选择和筛选;(2)FMT制备;(3)FMT的临床应用和剂量。每个工作组成员指定一名负责人来协调他们的小组,并向FMT联盟主席(J. Winston)提供他们负责主题的最终临床声明。每项声明的证据质量是根据推荐意见分级评估、制定和评价工作组(Grading of Recommendations Assessment, Development and Evaluation system)进行调整[11,12]。已发布的证据质量定义在方框 1 中提供。

每个工作组提供的声明由FMT联盟主席上传到在线投票系统(Qualtrics, Provo, Utah, USA)。采用改良的德尔菲法(Delphi)对所有声明达成共识 [10]。每一组主题声明都根据小组在在线投票期间的匿名反馈进行多轮修订。每次声明被上传并发送给伴侣动物FMT联盟成员进行评估。经过多轮之后,改良的德尔菲法使得本文所提供的所有声明达成了共识。
对于每一项声明,专家们对其同意程度进行如下评级:(1)强烈同意;(2)有保留地同意;(3)未决定;(4)不同意;(5)强烈不同意。如果专家选择了除 “强烈同意” 之外的任何选项,他们被要求添加评论来解释他们的保留意见和/或对该声明的不同意之处,并具体说明如何改进该声明。对于每项声明,需要至少80%的专家“强烈同意”,该声明才能被纳入临床FMT指南。所有未达到80%同意率的声明都要经过额外的几轮在线投票进行修订和再次评级。一旦每个主题的声明最终确定(达到80%或以上的同意率),工作组成员就会根据现有证据为每一项声明提供评论。然后,工作组负责人将最终部分提交给伴侣动物FMT联盟主席,并编制临床指南。
伴侣动物粪便微生物群移植临床指南
伴侣动物FMT的临床指南分为三个部分:(1)供体选择和筛选;(2)FMT制备;(3)FMT的临床应用和剂量。每个部分都由一系列声明组成,为兽医师提供与该主题相关的一般性建议。当有与本主题相关的证据时,也以评论的形式在每项声明下方提供,包括证据质量(方框1中的定义)。
第一部分:供体的选择和筛选
在本节中,提供了FMT供体选择和筛选的一般性建议。需要注意的是,应根据具体情况考虑其他因素,如地理位置(即传染病筛查)、财务资源(即对供体进行额外的血液检查)等。方框 2 提供了粪便供体筛选建议的总结。
健康状况
声明:供体应该临床健康(在全面的体格检查和病史中未发现异常)。
证据质量:低。
评论:虽然目前没有关于FMT供体的总体健康状况对FMT成功率或安全性影响的数据,但总体临床状态是一个容易识别的整体健康指标。临床表现不正常的动物可能会增加病原体传播的风险,或者胃肠道微生物群发生改变(即生态失调),这是合理的。考虑到存在大量临床正常的动物,排除临床异常的动物几乎没有实际限制,因此预防原则支持要求供体在临床上是正常的。可能在某些情况下,临床异常可以被认为是无关紧要的(例如,轻度的骨科异常或牙科疾病),而该动物可能被选作供体。然而,默认情况应该是动物临床正常且未接受任何药物治疗。
声明:供体应该具有可接受的体况评分(BCS:4 - 6/9)。
证据质量:低。
评论:目前的科学文献没有提供关于BCS异常供体(犬的理想BCS:4 - 5;猫的理想BCS:5)粪便移植对受体肠道微生物生态系统影响的信息。同样,也没有数据表明来自超重或肥胖供体的犬FMT受体的BCS增加。与身体状况正常的个体相比,体重指数显著升高、肥胖或患有2型糖尿病的人,由于其肠道微生物群发生了改变,所以不被视为合格的粪便供体 [13]。在一项涉及犬的临床试验中,观察到肥胖犬和瘦犬之间肠道微生物群略有差异 [14]。
声明:供体无当前(最近4个月内)或慢性胃肠道症状病史(例如,呕吐、腹泻、体重减轻、食欲不振、黑便或便血)。
证据质量:高。
评论:研究表明,狗和猫的胃肠道疾病常常会导致其肠道微生物群发生变化,并且某些胃肠道疾病的病因可能会通过FMT传播 [15]。任何可通过粪口途径传播的病原体都应被认为可通过FMT传播,并且狗和猫的某些急性胃肠道疾病的病因具有粪口传播的可能性。在慢性肠病中,肠道微生物群的变化可能非常显著且持续存在,而在急性胃肠炎和犬急性出血性腹泻综合征(AHDS)中,这种变化可能较小且只是暂时的[16 - 20]。

声明:如果出现急性胃肠道症状(<2 周),等待3个月,然后重新对供体进行筛查。
证据质量:低。
评论:从狗身上获得的数据表明,在急性胃肠道疾病发作期间,肠道微生物群仅发生轻微且短暂的变化 [21]。临床症状消退后,这些狗的肠道微生物群通常在几周内恢复正常 [21]。这在患有急性腹泻和急性出血性腹泻综合征(AHDS)的狗中已得到证实 [15,17,19]。然而,缺乏全面的大规模研究来评估狗和猫在急性胃肠道疾病发作后胃肠道中感染性病原体存在的持续时间,并且已知某些感染性病原体可能会持续数周被排出。因此,出于预防考虑,在用作供体之前应规定一个限制期。
声明:永久排除有持续超过3周慢性胃肠道症状病史的动物作为供体,这可能提示潜在的慢性肠病。
证据质量:低。
评论:大量临床研究表明,与健康个体相比,相当一部分患有慢性肠病的动物其肠道微生物生态系统发生了改变[16,22]。鉴于FMT的目的是恢复受体健康的肠道微生物生态系统,因此,排除生态失调的动物作为供体是至关重要的。
年龄、基础信息和环境
声明:供体应至少12个月龄,且小于其预期寿命的75%(例如,对于预期寿命为16 - 17年的品种,应小于12 岁)。
证据质量:低。
评论:小于1岁的犬只其生理性肠道微生物群与成年犬猫不同 [23,24]。在人类医学中,有证据表明由于体内各种炎症过程,老年受试者的肠道微生物生态系统会发生负面变化 [25]。在犬类中,一项研究显示,老年犬的肠道功能标志物存在轻微改变 [26]。可以确定犬猫拥有稳定成年肠道微生物群的年龄尚不清楚,但基于专家意见,选择了1岁作为截止年龄。
声明:无品种限制
证据质量:低。
评论:目前缺乏针对犬猫肠道微生物群的品种特异性变化的研究。没有证据表明特定品种与其他品种相比,肠道微生物群存在改变。
声明:对于有农场/野生动物接触、狗公园、有寄宿经历等的供体,只要动物健康,无胃肠道症状,就没有理由将该供体排除。
证据质量:低。
评论:在与众多其他个体密切接触的动物中(如上述情况),从其他犬猫身上获得感染性病原体、传播肠道致病菌和多重耐药细菌的风险可能会增加 [27]。然而,目前尚无大规模研究明确风险增加的程度,这就是为什么在这些情况下饲养的犬猫不应一律被排除作为供体的可能性。因此,对供体进行某些感染性病原体检测(见后文)尤为重要。
声明:排除在过去4 周内住院或寄宿超过8至10小时的动物,因为这可能增加感染性病原体的风险。
证据质量:低
评论:为了最大限度地减少因与潜在患病动物密切接触而感染传染性病原体的风险,根据专家意见,建议暂时排除这类动物作为潜在供体。
声明:首选来自单猫家庭的室内猫,以将感染风险降至最低。
证据质量:低。
评论:无论猫生活在室内还是室外,都容易携带寄生虫和传染病。然而,捕食野生动物或食腐行为会显著增加其感染某些寄生虫的风险 [28]。一项针对室内和室外猫寄生虫感染风险的综合荟萃分析发现,限制户外活动有助于减少寄生虫感染 [29]。在流浪猫流行率非常高且难以严格识别室内猫的地理区域,可以按照后文讨论,流浪猫作为潜在供体进行选择。
声明:理想情况下,猫粪便供体在接受筛查之前应在家中至少生活6周。
证据质量:低。
评论:由于猫白血病病毒(FeLV)p27 抗原即时检测在感染后可能需要长达6周的时间才会呈现阳性 [30],因此在筛查供体前应有相应的等待期。需要注意的是,在这6周内不应在家庭中引入新的猫。如果严格意义上的室内猫数量较少,纳入流浪猫可能是必要的;然而,理想情况下,猫在捐赠粪便前应在室内饲养6周。
抗菌药物、抑酸剂和其他引起生态失调的药物史
以下是每一种可能诱发生态失调的药物在考虑粪便捐赠之前所需的最小等待时间(从给药结束开始)。
声明:抗菌药物(口服/注射):至少6个月,并重新筛查供体是否存在肠道菌群失调。
证据质量:中。
评论:目的是要有一个肠道微生物生态系统健康的粪便供体。研究表明,抗菌药物对犬猫的肠道微生物群产生不利影响,导致生态失调[31]。对于具有抗厌氧菌谱的抗菌药物,如甲硝唑和泰乐菌素尤其如此,它们会导致严重的肠道生态失调 [32,33]。研究表明,在停止抗菌治疗后恢复正常肠道微生物群所需的时间在个体之间差异很大,有时可能需要几个月 [24,32,33]。
声明:抑酸剂(任何改变胃 pH 值的药物):至少2周。
证据质量:中。
评论:应确定使用抑酸剂的原因以评估额外风险。研究表明,奥美拉唑和埃索美拉唑可能导致暂时性生态失调,但据观察,胆汁酸转化细菌 Clostridium hiranonis(新命名为 Peptacetobacter hiranonis)的丰度仍在参考范围内 [34,35]。肠道微生物群通常在停止治疗后 1-2 周内恢复正常 [34-36]。这些发现已在犬科动物中得到证实,也适用于猫 [37]。目前缺乏关于H2受体拮抗剂对肠道微生物群影响的研究。
饮食和其他补充剂
声明:排除在过去 30 天内食用过生食或未经加工零食的动物。
证据质量:中。
评论:食用生食或未经加工零食的动物粪便中携带病原体以及产超广谱 β- 内酰胺酶(ESBL)微生物的风险会增加。研究表明,喂食生食的狗的粪便中经常含有肠道致病菌,如空肠弯曲杆菌(Campylobacter jejuni)、沙门氏菌(Salmonella)和单核细胞增生李斯特菌(Listeria monocytogenes),其出现频率比喂食商业饲料的狗的粪便要高 [38,39]。此外,在喂食含鸡肉生食的狗身上,这些细菌的数量更多 [39]。超过50%喂食生食的狗的粪便中携带产 ESBL 细菌 [40 - 42]。此外,有证据表明,喂食生食的狗肠道微生物群发生了改变 [42]。因此,建议避免传播含有肠道病原体或多重耐药细菌的粪便物质,并且应将喂食生食的动物排除在粪便供体之外。动物可以转换为加工/煮熟的食物,然后在食用新食物1个月后进行筛查。
对于膳食补充剂无法给出明确的建议。尽管益生菌能够改变肠道微生物群,但并没有观察到具有临床意义的变化 [43]。目前,没有足够的证据能就给粪便供体使用益生菌一事给出论断。
微生物筛查
声明:应在可行的情况下进行微生态失调指数(DI)检测,以排除微生物组异常的动物。
证据质量:中。
评论:犬科和猫科动物粪便的微生态失调指数(DI)是经过验证和标准化的检测方法,旨在评估微生物组的变化 [16,22]。最近一项对27项研究的荟萃分析显示,犬DI(基于核心菌群如C. hiranonis(新命名为P. hiranonis)等计算得出的)是肠道功能的一个潜在有用的生物标志物 [44]。此外,已经证实了非靶向宏基因组测序与DI之间存在紧密的相关性 [45]。DI是犬科和猫科动物粪便微生物群落变化的可靠指标,与测序技术相比,它具有更高的可重复性和分析灵敏度,可以更好地在个体之间以及同一个体内不同时间进行比较[45]。供体的DI应低于 0,且所有纳入检测的细菌类群的丰度都应在其参考范围内。有关利益冲突声明,请参阅“披露”部分。
声明:不建议使用基于下一代测序技术来评估微生物组,因为这些技术尚未经过验证,而且对于如何解读单个动物的检测结果也没有标准的指导意见。
证据质量:低。
评论:虽然近期的技术能够对微生物群落进行详细的研究,但在个体水平上,人们对“正常”情况及其变化的理解还很欠缺 [46,47]。对于肠道微生物群落,人们的了解还不够充分,无法确定对于FMT供体来说,什么样的结果属于正常/健康(或可接受)的,什么样的结果属于异常(或不可接受)的。
声明:常规细菌培养不是评估整个微生物组多样性的有效工具,但培养仍可用于检测特定的肠道病原体。
证据质量:中。
评论:粪便培养是一种诊断技术,用于鉴定犬和猫体内特定的或机会性肠道致病菌和真菌。许多商业性兽医诊断实验室都提供这项服务,以评估粪便的微生物组成,并对正常与异常微生物种群之间的平衡给出自己的解释。然而,这种方法存在局限性,因为基于有氧培养的方法无法充分反映以厌氧菌为主的肠道微生物群情况 [48]。一项将三家商业实验室的细菌培养结果与犬类DI进行对比的研究表明,粪便培养对于识别犬类的肠道生态失调并无帮助 [49]。事实上,对培养结果的解释可能会产生误导。
感染性疾病筛查
声明:建议对粪便供体进行以下感染性疾病的检测:
沙门氏菌Salmonella(推荐粪便培养或聚合酶链式反应 [PCR])
空肠弯曲杆菌C. jejuni(推荐由有经验的实验室进行PCR或培养,并在物种层面进行鉴定)
贾第鞭毛虫Giardia(推荐免疫荧光测定 [IFA]、SNAP 检测、粪便抗原检测,或用硫酸锌漂浮法、PCR,或这些方法的组合)
隐孢子虫Cryptosporidium(推荐 IFA 或抗原检测)
其他肠道寄生虫(推荐粪便离心漂浮法、粪便抗原检测、贝尔曼法以及 PCR)
针对猫的额外检测包括以下内容:
胎儿/blagburni 三毛滴虫Tritrichomonas foetus/blagburni(推荐对新鲜粪便样本进行 PCR 检测)
肠道冠状病毒(推荐 PCR 检测;如果是来自单猫家庭的室内猫,对猫进行一次检测即可)
猫免疫缺陷病毒(FIV)和猫白血病病毒(FeLV)(推荐 SNAP 三联检测或 FeLV 抗原酶联免疫吸附测定 [ELISA]、FIV 抗体检测;关于 FeLV 检测,猫应为室内饲养,且在检测前至少 6 周未与已知感染的猫接触)
证据质量:中。
评论:已表明所列举的这些微生物有可能诱发胃肠道疾病以及其他器官系统的疾病。因此,携带这些微生物的动物应被排除在外 [50]。
可选的感染性疾病筛查
声明:以下感染性疾病筛查对于粪便供体可选择进行:
产气荚膜梭菌C. perfringens netF 毒素基因(PCR;可选择进行,在临床健康的狗中很少出现)注意:不建议对产气荚膜梭菌肠毒素和 α 毒素基因进行筛查,因其在狗和猫中的临床意义尚不清楚。
艰难梭菌C. difficile(PCR;可选择进行,因为在狗和猫中致病性证据较弱且人畜共患病的可能性尚不清楚;取决于临床医生的偏好)
证据质量:中。
评论:目前的证据表明,netF(一种 β 成孔毒素)很可能是导致犬急性出血性腹泻综合征(AHDS)的产气荚膜梭菌菌株中的主要毒力因子 [51,52]。另一种毒素,即产气荚膜梭菌肠毒素(CPE),在AHDS犬的粪便中比在对照组犬的粪便中更常见 [53]。尽管 AHDS 并非一种传染性疾病,但特定毒素在其疾病发展过程中的作用尚不明确,而且编码 netF 的产气荚膜梭菌菌株在健康犬中很少被检测到;因此,避免可能增加暴露风险的因素或操作似乎是谨慎之举 [51,53,54]。
艰难梭菌是人类常见的病原体,常常会导致与抗生素使用相关的假膜性结肠炎 [55]。已有研究表明,伴侣动物携带与人类相同或相似的艰难梭菌核型,这表明可能存在种间传播 [56,57]。然而,最近的一项研究显示,艰难梭菌的种间传播很少发生在有人感染艰难梭菌的家庭中[57]。据估计,艰难梭菌在犬中的流行率可高达19%,但它很少引发临床症状[55]。在犬中,艰难梭菌的携带情况似乎与肠道生态失调存在关联[58,59]。
粪便捐赠者筛查频率
声明:应对粪便供体每6个月进行一次筛查,根据风险/环境(流行区域)情况,可能需要更频繁地筛查。
证据质量:低。
评论:目前尚无临床试验表明肠道微生物群在6个月或更长时间内的恢复能力,但专家意见认为,在没有重大环境变化或疾病的情况下,犬和猫的肠道微生物群在几个月内会保持相对稳定。在流行地区,兽医可自行决定应更频繁地进行检测。
第二部分:粪便微生物群移植制备
在本节中,提供了有关粪便采集和FMT制备的一般性建议。重要的是,这些建议需要根据各机构的资源和设施情况进行调整和优化。需要考虑的因素包括可用的人员和设备(即可用的-80℃的冰箱、冻干机等等)。图 1 提供了FMT产品制备和加工的概述。
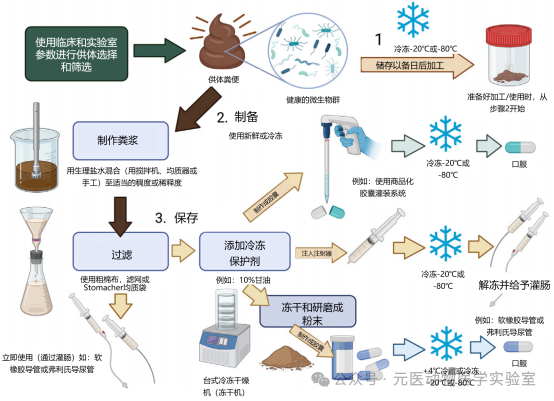
图 1 FMT产品制备及加工流程概述。在完成粪便供体的选择和筛选之后,自然排出的粪便可用于 FMT 的制备和加工。新鲜排出的粪便对于施行FMT是最理想的。如果无法使用新鲜粪便,可以将粪便储存起来,直至加工和/或使用(步骤 1)。针对新鲜粪便和/或冷冻粪便的处理步骤包括制作粪便泥浆以及对FMT产品的过滤(步骤 2)。一旦FMT产品制备完成,可以立即使用或可以储存(步骤 3)。如果要储存 FMT 产品,可以添加冷冻保护剂。FMT 胶囊可经口服施用,加工处理后的粪便泥浆可通过直肠灌肠的方式施用。(由BioRender.com创建)
粪便采集
声明:应穿戴个人防护服、手套、口罩和护目镜。
证据质量:低。
评论:粪便样本的处理应符合当地的卫生和安全规定。此外,根据处理方法的不同,处理粪便材料的人员可能会发生意外污染情况。尽管目前尚无记录在案的在FMT制备过程中因污染而导致人员患病的案例,但小动物的粪便可能含有传染性人畜共患病原体。出于这个原因,伴侣动物 FMT 联盟建议,作为良好实验室规范的一部分,要通过避免自身与粪便材料接触来将感染风险降至最低。
声明:使用自然排出的粪便,且要在排便后立即进行采集。
证据质量:中。
评论:虽然这一点通常在犬身上是可以做到的,但对于猫来说可能更具挑战性。一项研究报告称,猫的粪便在室温下放置 4 天,其微生物群的组成和多样性并未出现显著变化 [60]。另一项研究在室温下放置了12小时,也得出了类似的结果 [61]。尽管这两项研究都未对细菌的活力进行调查,这可能会影响最终FMT产品的临床疗效,但这些发现表明,夜间自然排出的猫粪便可以在第二天进行处理。由于这两项研究使用的都是健康猫且采用了类似的方法学(DNA测序),根据目前的了解,建议最好在猫排便后的24小时内对其粪便进行处理。
声明:将粪便收集在干净的塑料袋、粪便收集管或玻璃容器中。
证据质量:低。
评论:在临床环境中,使用上述收集设备是最为实用的做法。遵循良好的实验室规范,通过降低被异物污染的风险,可确保粪便样本质量得到保存。兽医研究已经证实,在处理之前使用袋子和 / 或防漏容器中收集的样本具有临床疗效 [18,20]。
粪便处理前的操作
声明:一旦新鲜粪便自然排出,应尽快且在可行的情况下对其进行处理,要么将其施用于患病动物,要么进行储存(最好在排便后的2-6小时内)。
证据质量:中。
评论:值得注意的是,一项使用犬粪便的研究 [62] ,以及伴侣动物FMT联盟成员开展的其他未发表的有关犬和猫的研究发现,与新鲜粪便相比,冷冻后存活细菌的数量显著减少。
声明:如果无法立即进行处理,新排出的粪便应储存在 4℃的冰箱中,并尽快处理。
证据质量:低。
评论:尽管有关犬的情况仅有传闻信息,但暴露于氧气可能会降低细菌的存活能力。因此,在处理之前,建议将粪便放在密封袋或密封容器中,以减少氧气暴露。
声明:对于沾有垃圾的猫粪便,从粪便表面手动清除尽可能多的垃圾。这可以使用木制压舌板、勺子、橡胶刮刀和/或戴手套的手来完成。
证据质量:低。
评论:附着在粪便上的垃圾或异物可能会导致用于FMT灌肠的直肠导管阻塞。如果手动清除后仍有此类物质的残留,将在粪便悬液过滤过程中清除。
粪便处理
声明:粪便可在有氧条件及室温下进行处理。
证据质量:中。
评论:人类医学研究表明,无氧条件有助于保持专性厌氧菌的细菌活性,而在有氧条件下,物种丰富度似乎不会有显著改变[63,64]。然而,有氧处理明显更实用且更易于操作。由于在人类医学和兽医学针对不同疾病中的临床疗效,伴侣动物FMT联盟支持在室温下进行有氧处理[18,20,65 - 67]。在兽医学中,通过无氧制备来提高FMT疗效的潜力仍不确定。
声明:可向粪便中添加无菌的0.9%生理盐水(无添加剂的氯化钠溶液)或磷酸盐缓冲盐水(PBS)以制成粪便悬液。
证据质量:低。
评论:虽然已有描述使用自来水来制备FMT产品,但伴侣动物FMT联盟更倾向于使用无菌的0.9%生理盐水(临床实践中常规可得)或PBS以降低污染风险[68]。此外,尽管也有报道其他稀释介质,如脱脂牛奶,但大多数研究使用的是氯化钠溶液或PBS。
声明:根据FMT的给药方法,可采用1:1至1:5(粪便物质:溶液)的稀释比例来达到所需的一致性。
例如,如果通过灌肠给药,粪便悬液的浓度将取决于灌肠所用导管的大小(最常见的是1:1至1:5的稀释比例)。如果通过内镜进行FMT给药,则需要类似奶昔的稠度以便能轻松通过内镜通道(可能采用1:5的稀释比例)。
证据质量:低。
评论:在人类医学和兽医学中都有关于几种FMT稀释比例的报道。但目前尚无关于每种混合液的活性及疗效相关的数据。然而,当采用直肠灌肠给药时,浓度应尽可能浓稠,以保持较低的给药体积并防止渗漏。
声明:可使用多种方法来使粪便混合物均质化,例如:
使用专用的厨房式搅拌机/混合器或手持搅拌器进行混合;
在干净的塑料袋或Stomacher®均质袋(例如来自美国纽约波西米亚的Seward Ltd)中手动揉捏;
用勺子在小容器中混合(适用于少量粪便);
证据质量:低。
评论:尽管缺乏对FMT制剂直接比较的证据,但混合(区别于揉捏/其他类型的混合方式)可能存在的缺点是,未消化的物质和外来物质也会被混合进去,并可能最终出现在经过滤后的FMT粪便悬液中。
声明:为了从粪便匀浆中去除大颗粒(如草和毛发),可使用以下方法过滤粪便匀浆:
精细的厨房滤网。可以使用木制压舌板、勺子或橡胶刮刀将较稠的粪便泥浆挤压过滤网。
粗棉布(吸水性强、低绒的棉质布料)。使用前,先冲洗粗棉布以去除绒毛。然后将其铺在一个容器上,装入粪浆。收拢粗棉布的四角并拧动,把液体挤干。戴上手套,用手紧紧挤压粗棉布的中间部分,使粪浆沥干。你也可以用木制压舌板、勺子或橡胶刮刀按压滤出的粪便内容物,把液体挤压出来。
另一种方法是使用Stomacher®均质过滤袋(来自美国纽约波西米亚的Seward Ltd)
证据质量:低。
评论:已有报道使用Stomacher®均质袋进行人的FMT 加工[69]。
由于本指南内容较多,剩余部分翻译见伴侣动物粪便微生物群移植临床指南(译文)下
元医肠道菌群检测










