什么是链球菌?
链球菌属(Streptococcus)为革兰阳性球菌,成对或链状排列,无芽胞、无鞭毛,幼龄菌株具有由透明质酸形成的荚膜,有些菌株有菌毛。为兼性厌氧菌,对营养要求高,部分嗜CO2。生长依赖特殊培养基,如含血培养基,通过同型乳酸发酵分解葡萄糖。无触酶,种类繁多。主要分布于人或动物的呼吸道、肠道、泌尿道及自然界,少数可致病或条件致病。根据溶血现象,链球菌分为α-、β-、γ-三种类型。
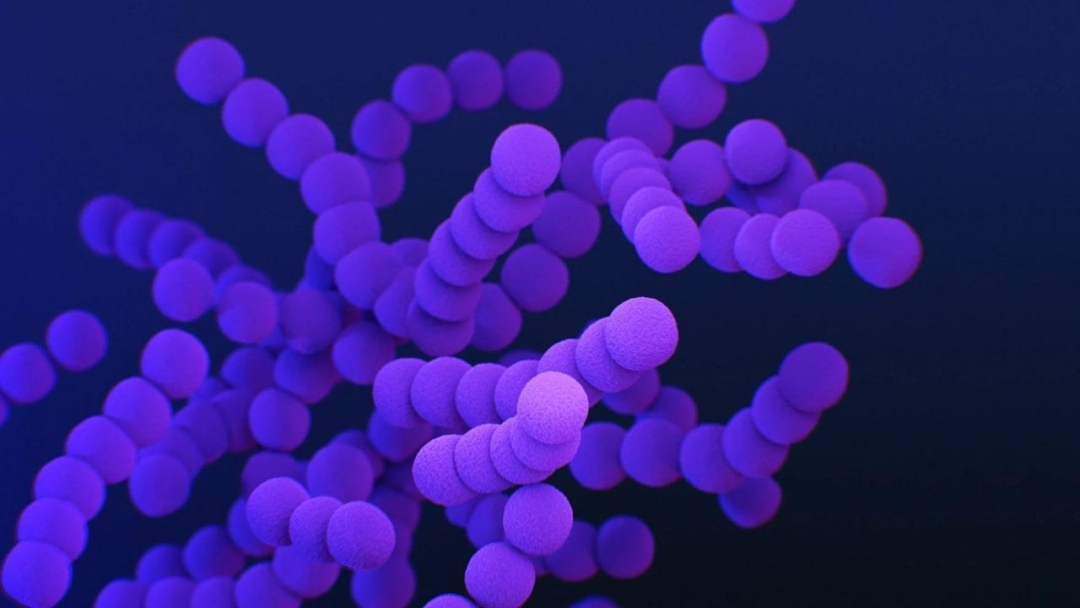
图1:电镜下的化脓性链球菌(图源lifeder.com)
近年来发现许多链球菌细胞壁中有一种蛋白成分,为链球菌蛋白G,能与人及多种哺乳动物的LgGFc段结合,但不和其它段结合。与葡萄球菌的SPA蛋白一样在细胞免疫学中有研究价值。致病性链球菌细胞壁上的脂磷壁酸等与动物皮肤及黏膜表面的细胞具有高度的亲和力,其荚膜分成、M蛋白等具有抗吞噬作用。
此菌抵抗力不强,对热敏感,高温可很快将其灭活,也能被常规浓度的各种消毒剂杀死。 致病性链球菌可产生多种毒素和酶,能导致人及马、牛、猪、羊、犬、猫、鸡等多种物种患病。
01 分类
链球菌是一类多样化的细菌,根据遗传关系和特性,可以细分为多个类别。 链球菌的分类不仅有助于理解其生物学特性,还对于疾病诊断和治疗具有重要意义。例如,肺炎链球菌是引起肺炎等严重感染的主要病原体,而草绿色链球菌则常在口腔中发现,与牙齿健康密切相关。此外,其他链球菌相关菌株,如肠球菌(Enterococci)等,这些菌株在医学和微生物学领域也具有重要意义。
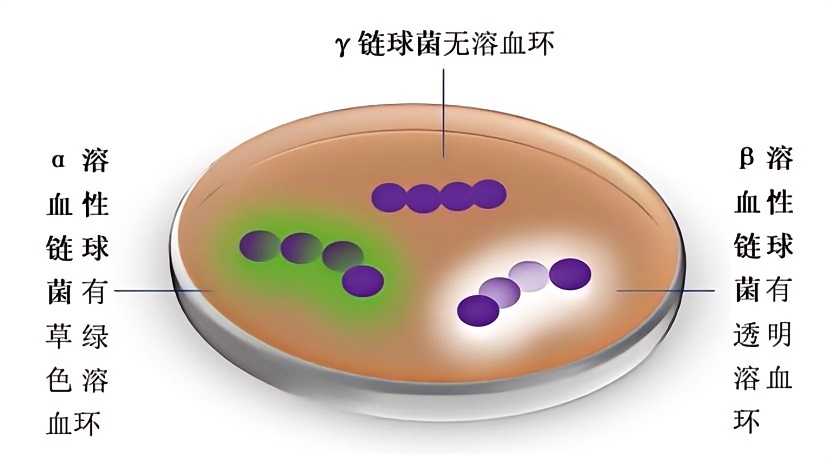
图2:三种链球菌在培养基上的溶血表现(图源yxj.org.cn)
按血平板上的溶血现象来分:
甲型-α溶血(草绿色溶血)链球菌,多为条件致病菌。
乙型-β溶血(乙型溶血)链球菌,致病性一般较强
丙型-γ溶血(不溶血),一般无致病性。
按抗原来分类:目前可分为A-V共20个种群。
动物致病菌以B、C群居多,人致病菌以A群为主。特异性抗原是存在于链球菌细胞壁中的多糖成分,其抗原决定簇为氨基糖苷类。如A群链球菌是鼠李糖N乙酰葡糖胺,C群为鼠李糖N乙酰半糖胺。
02 致病性及毒力因子
链球菌溶血素
分为对氧敏感和对氧稳定两种。前者为溶血素O,后者为溶血素S。溶血素O为一种胆固醇结合的穿孔毒素,对氧敏感,所含-SH基遇氧被氧化为SS基,暂时失去溶血能力,加入亚硫酸钠或半胱氨酸等还原试剂可恢复溶血作用。溶血素O对心肌有较强的毒性作用,也能破坏中性粒细胞、巨噬细胞和神经细胞,静脉注射小鼠和家兔可以迅速致死。各菌群产生的溶血素O抗原性相同,人和动物感染后均可以产生溶血素O的抗体。溶血素S是含糖的小分子肽,呈β溶血,无抗原性,对热和酸敏感,不易保存。溶血素S也能破坏白细胞、血小板等,静脉注射家兔也可致死。
制热外毒素
主要由A群链球菌产生,C和G群的一些菌株也产生。此毒是一种蛋白质,人的猩红热主要由它产生,小剂量注射可导致家兔红疹。
链激酶
它能够将纤溶酶原激活为纤溶酶,从而溶解血栓。有助于细菌在宿主组织中的扩散,逃避宿主的免疫防御机制,导致感染的扩散和加重。在临床上,链激酶也被用作溶栓药物,用于治疗心肌梗塞、肺栓塞等血栓性疾病。
03 主要致病菌
β溶血性链球菌 (β-hemolytic streptococcus)
β溶血链球菌主要是A群链球菌及B群链球菌的部分菌种。其中A群链球菌的感染可占链球菌感染的90%,是链球菌属中主要的致病群,内有M蛋白有抗吞噬作用,且与心肌、肾小球基底膜有相似的抗原成分,可引起机体产生超敏反应,此外可以产生外毒素和多种侵袭性酶。
致病力强可以引起痈、蜂窝织炎、急性炎症、丹毒。以下主要介绍无乳链球菌和马链球菌亚种 。
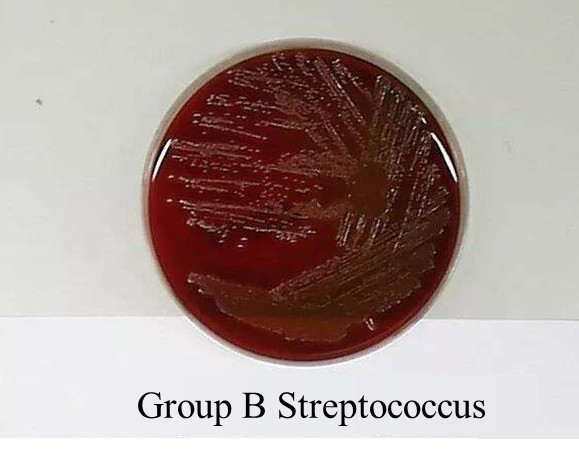
图3:GBS在血平板上培养24小时后,可见灰白色、表面光滑、珍珠状的β溶血性菌落。
无乳链球菌 (Streptococcus agalactiae)
A群β溶血性链球菌,牛乳腺炎的病原体,在自然界中分布广泛。在健康的牛的皮肤和乳房也可以分离到这些菌。常呈现长链状,在普通培养基上生长不良,血平板上为淡灰色、隆起、闪光的小菌落,无乳链球菌呈α或β溶血,一些菌株可产生黄色、柠檬色或砖红色色素,在血清肉汤中生长,乳房链球菌保持均匀浑浊,后在管底絮状沉淀。
可引发牛、山羊和绵羊的急性、慢性乳腺炎。该菌还能引起骆驼的乳腺炎和侵入性疾病,偶可引致犬、猫、鱼和仓鼠疾病。此外,该菌可引起婴儿败血症、人心内膜、脑膜炎和肺炎等,人医临床对其以B群链球菌相称。近年来,我国南方养殖的罗非鱼等暴发流行病,死亡率高。病鱼发生脑膜脑炎,主要表现为眼球突出、眼眶充血、腹部膨大及游姿平衡失调等。经较早的细菌分离鉴定表明,病原为无乳链球菌以及海豚链球菌,近期则只有无乳链球菌。
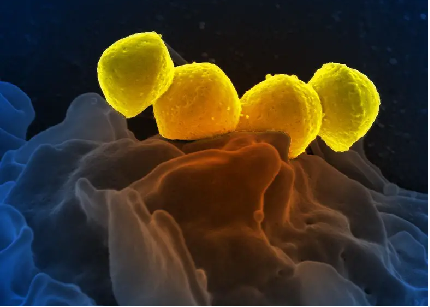
图4:嗜中性粒细胞上的A群链球菌(图源microscopemaster.com)
马链球菌 (Streptococcus equi)
C群β溶血性链球菌,根据其类M蛋白抗原性的差异,至少可分15个血清型。本菌旧称为普疫链球菌,普遍存在于动物的黏膜,尤其是马属动物的皮肤、上呼吸道黏膜、扁桃体以及生殖道等处,可致多种家畜的炎症及败血病,有些菌株具有荚膜。革兰阳性,但着色不均。在血平板上形成透明、闪光、微隆起、有黏性的露滴状菌落,可见明显的B溶血环。血清肉汤培养,轻度浑浊,继而变清,于管底形成沉淀。
可致多种动物疾病,包括马的创伤感染、败血症、子宫炎、流产、关节炎、腹膜炎、幼驹脐带炎;牛乳腺炎、子宫炎;猪败血症、关节炎、流产;羔羊和幼犬伤口感染、败血症、肺炎;鸡败血症等。偶尔有感染人的报道,系食用污染的牛乳制品所致。实验动物以家兔和小鼠最为敏感,家兔静脉或腹腔接种本菌后,小鼠腹腔接种后,均可致死。豚鼠及大鼠对本菌有抵抗力。在20世纪70和80年代,从我国各地发生的猪链球菌病及羊急性败血症分离的链球菌株,多数为本菌。在本实验室最常培养出的致病菌为马链球菌兽疫亚种(Streptococcus equi ssp zooepidemicus)。
肺炎链球菌 (Streptococcus pneumoniae)
在血平板上呈光滑、灰白、扁平状、有荚膜。其荚膜多糖可使肺炎链球菌呈黏液状。因产自溶酶,培养 48h 后呈“脐窝状”,口腔和鼻咽部的正常菌群,一般不致病,但患者抵抗力低下或寒冷刺激下可引起大叶性肺炎或支气管肺炎,与口腔鼻咽部其它菌群相比在血平板上生长不具有竞争优势,在呼吸道标本中培养出来,实验可根据具体情况选择是否做药敏。
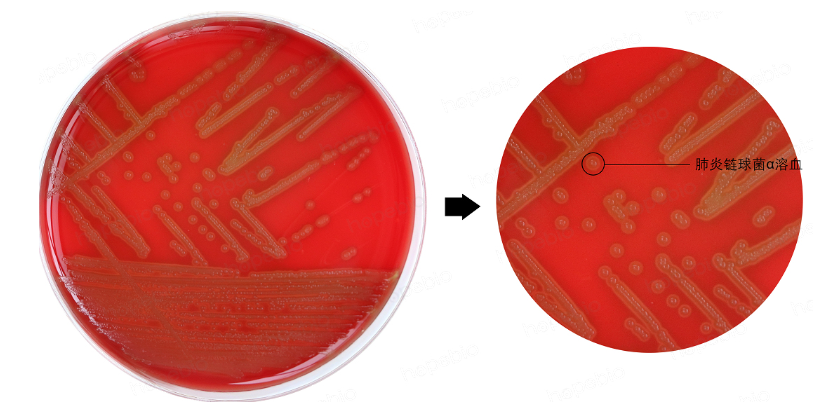
图5:肺炎链球菌在血平板上呈α溶血(图源hopebiol.com)
肺炎链球菌可发生变异,主要表现在菌落类型、菌体形态、溶血现象的消失、毒力减弱或消失等。在抗生素等因素影响下,可变为 L型。菌落一般可分为3种类型:黏液型 (M)光滑型(S)及粗型(R)新分离的链球菌,因其荚膜多糖丰富,多为M型。在普通培养基上多次移植时,可见失去荚膜而变为无力的R型。如果 M型及S型菌株的DNA,加人R型菌株培养物中,可使R 型菌株变为S型。如果将抗药菌株的 DNA加到非抗药菌株培养物中,也可使后者变为抗药性的菌株。本菌的抵抗力不强,可引起人类的肺炎,常致犊牛、羔羊、仔猪的败血症,尤其出生后数日内的仔畜,死亡率极高。
肺炎链球菌的抗原成分较复杂,按荚膜多糖抗原不同,分为 84 个血清型。其细胞壁中也有与A群链球菌相似的M蛋白,但抗原性有差别。人感染本菌后,可以产生特异性免疫。
草绿色链球菌 (Streptococcus viridans)
草绿色链球菌是人体呼吸道上的正常菌群,动物上出现较少,通常不致病,但是如果在血液或无菌液体中有临床意义,此外具有A、C、F或G群抗原形成小菌落得β溶血菌株被分到草绿色链球菌中,判定药敏折点时应使用草绿色链球菌的折点。
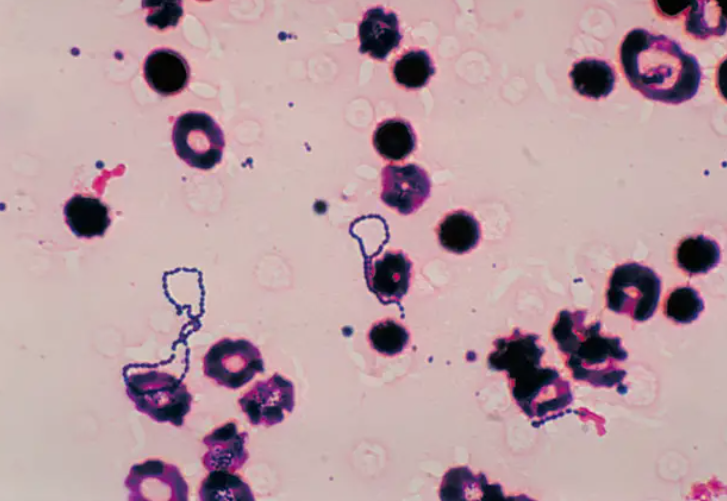
图6:草绿色链球菌镜下(图源microscopemaster.com)
肠球菌 (Enterococcus)
原属D族链球菌,后证实不为链球菌属。广泛分布于自然界,为人体和动物肠道的正常菌群,在血平板上呈白色、圆形,一般有α溶血,也可以不溶血。
肠球菌有黏附素、溶血素等细胞因子,常引起的肠道外感染有:尿路感染、盆腔感染、菌血症、心肌内膜炎等,是泌尿道感染的第二大菌属。近年来发现,人的肠球菌不仅可致医院感染,而且肠球还可能充当肠道中菌的转移耐药基因的供体菌,因而备受关注。
肠球菌为圆形或椭圆形、呈链状排列的革兰阳性球菌,老龄菌可呈革兰阴性,对环境的耐受性极强,可耐酸碱。在一般环境可存活数周,可在 10~45℃生长,大多数菌株可耐受 60℃30min。2002年以来我国新疆北部地区的盖羊在春季发生急性死亡的传染病,表现为神经症状及败血症,经鉴定病原为具有β溶血的肠球菌和屎肠球菌。致病机理不明,推测可能与抗生素的滥用导致菌群失调有关。肠球菌因对抗生素有较大抗性而成为机会致病菌。
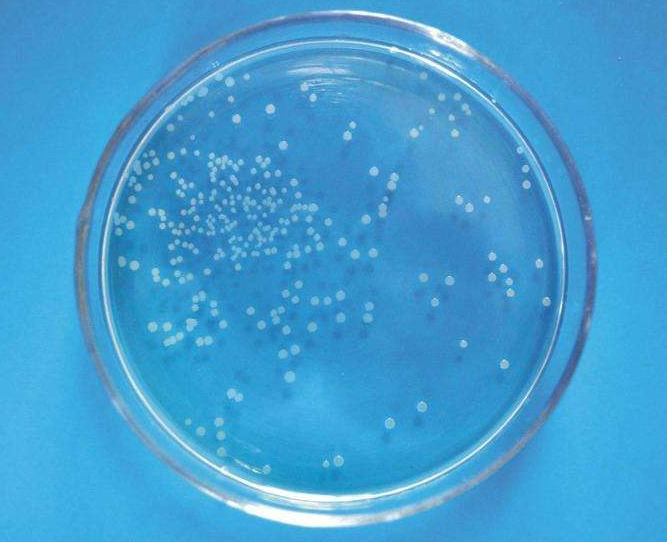
图7:肠球菌菌落呈乳白色、边缘整齐、较为平坦(图源xcx006.web1991.com)
04 药物选择
实验的判断标准参照美国临床实验室标准化协会(CLSI)抗微生物药物敏感性试验标准制定。应关注细菌的天然耐药谱,用药时应选择避免。不同细菌的药敏结果不尽相同,药敏报告无法显示所有临床常见药物,可通过其耐药机制和标志性药物预测其它抗菌药物的敏感性。
A组:一般认为常用且有效的药物,所列的药物用作常规试验,并常规报告结果。
B组:与A组的效果基本等同,可用于常规试验,但只做选择报告,一般作为A组药物耐药时使用。
C组:替代性、补充药物,一般在治疗过敏患者、治疗对数种药物耐药特别是对某一类抗生素均耐药的细菌感染时使用。
O组:有临床适应症但通常不作为常规测试与报告药物
U组:仅用于治疗泌尿道感染时所使用的抗生素。
表1:β溶血性链球菌
药物分组 药物名称
A组 | 红霉素、青霉素、复方新诺明、氨苄西林 |
B组 | 头孢吡肟、头孢噻肟、万古霉素 |
C组 | 头孢洛林、氯霉素、左氧氟沙星、氧氟沙星、利奈唑胺、喹奴普丁、头孢洛林 |
O组 | 多尼培南、厄他培南、美罗培南、阿奇霉素、克拉霉素、地红霉素、四环素、氯霉素 |
使用肉汤稀释法测定β溶血链球菌对氯霉素、克林霉素、红霉素、利奈唑胺和四环素时,拖尾生长会造成终点值难以判定,此时可以忽略底部的微弱生长。
具有A、C、F或G群抗原形成小菌落β溶血菌株被分到草绿色链球菌中,判定药敏折点时应使用草绿色链球菌的折点。
青霉素敏感可以预报以下β内酰胺类药物药敏结果为敏感:氨苄西林、氨苄西林/舒巴坦、阿莫西林、阿莫西林/克拉维酸、头孢克洛、头孢地尼、头孢妥仑、头孢吡肟、头孢噻肟、头孢丙烯、头孢罗膦、头孢唑肟、头孢曲松、头孢呋辛、多尼培南、厄他培南、亚胺培南、氯碳头孢、美罗培南。仅对A群链球菌还包括头孢克洛、头孢地尼、头孢丙烯、头孢呋辛、头孢泊肟、头孢匹林。
红霉素药敏可以预报阿奇霉素、克拉霉素、地红霉素的敏感性。左氧氟沙星的敏感性可以预报吉米沙星和莫西沙星的敏感性。
β溶血性链球菌首选青霉素和氨苄西林,由于β溶血的链球菌中极少见青霉素和氨苄西林的非敏感菌株,实验室可不对青霉素和β内酰胺类的药物做药敏试验。
因为对青霉素敏感的β链球菌属可以对红霉素和克林霉素耐药,对低危险性青霉素过敏者仍然建议使用青霉素和氨苄西林,对高危险性青霉素耐药的过敏者应进行诱导克林霉素试验。
诱导克林霉素试验:细菌体内erm基因编码的甲基化可以减低药物与rRNA靶位的结合,若erm基因稳定表达可以表现对红霉素、克林霉素等大环脂类、林可酰胺类药物的耐药。但在某些情况下erm基因的表达需要诱导剂,而红霉素可以作为这种诱导剂。具有该诱导型的菌株可在体外表现红霉素耐药、克林霉素敏感。诱导克林霉素实验往往用来筛选该类菌株:
1. 制备0.5麦氏的菌株悬液,用涂布法均匀涂在mh平板上。
2. 将15ug的红霉素和2ug的克林霉素纸片相邻放置,边缘相距15-26mm。
3. 在35℃°的环境中培养16-18小时,若靠近红霉素一侧的克林霉素抑菌圈出现截屏现象及“D”字样式,及表示该菌株为诱导克林霉素阳性耐药菌株。
头孢洛林治疗β溶血性链球菌时折点基于600mg q12小时给药方案。
表2:肺炎链球菌
药物分组 药物名称
A组 | 红霉素、青霉素、复方新诺明 |
B组 | 头孢吡肟、头孢曲松、头孢噻肟、万古霉素、美罗培南、四环素、多西环素、吉米沙星、左氧氟沙星、莫西沙星、克林霉素 |
C组 | 头孢呋辛、头孢克洛、头孢洛林、氯霉素、阿莫西林、阿莫西林/克拉维酸、利奈唑胺、厄他培南、氨苄西林 |
O组 | 多尼培南、阿奇霉素、克拉霉素、地红霉素、氧氟沙星 |
使用肉汤稀释法测定肺炎链球菌对氯霉素、克林霉素、红霉素、利奈唑胺和四环素时,拖尾生长会造成终点值难以判定,此时可以忽略底部的微弱生长。由于培养基中可能存在的拮抗剂,甲氧苄啶和磺胺类药物允许出现菌株轻微生长,应读取对照孔相比细菌生长减少大于等于80%孔的浓度为终点浓度。
检测阿莫西林、氨苄西林、头孢吡肟、头孢噻肟、头孢曲松、头孢呋辛、厄他培南、亚胺培南、美罗培南对肺炎链球菌的敏感性时,纸片扩散法不可靠,应选择MIC法。
非脑炎膜分离株:青霉素MIC≤0.06ug/ml(或苯唑西林≥20mm)可以预报以下β-内酰胺了药物药敏结果为敏感:氨苄西林、氨苄西林舒巴坦、阿莫西林、阿莫西林/克拉维酸、头孢克洛、头孢地尼、头孢妥仑、头孢吡肟、头孢噻肟、头孢丙烯、头孢罗膦、头孢唑肟、头孢曲松、头孢呋辛、多立培南、厄他培南、亚胺培南、氯碳头孢、美罗培南。
苯唑西林抑菌圈>20mm的肺炎链球菌可报告对青霉素敏感,若苯唑西林的的抑菌圈<20mm,则需要使用MIC法测定肺炎链球菌对青霉素的敏感性。
红霉素药敏可以预报阿奇霉素、克拉霉素、地红霉素的敏感性。左氧氟沙星的敏感性可以预报吉米沙星和莫西沙星的敏感性。
青霉素MICs<2ug/ml,肺炎链球菌引起的非脑膜炎感染,肾功能正常的成年人每4小时静脉给药至少200万单位。使用青霉素治疗肺炎链球菌的脑炎膜感染时,需用最大剂量静脉给药治疗。
阿莫西林或阿莫西林/克拉维酸治疗肺炎链球菌时,折点基于阿莫西林500mg q8小时或875mg q12小时口服给药方案。
用头孢吡肟和头孢曲松治疗肺炎链球菌的脑炎膜感染时建议按照最大剂量给药。
治疗青霉素和氨苄西林高度耐药的肺炎链球菌可以使用万古霉素和左氧氟沙星或莫西沙星联合用药。
表3:草绿色链球菌
药物分组 药物名称
A组 | 青霉素、氨苄西林 |
B组 | 头孢吡肟、头孢噻肟、万古霉素、头孢曲松 |
C组 | 氯霉素、克林霉素、红霉素、利奈唑胺、奥利万星、达巴万星、达托霉素 |
O组 | 多尼培南、厄他培南、美罗培南、阿奇霉素、克拉霉素、地红霉素、氧氟沙星 |
草绿色链球菌包括以下5个菌群:变异链球菌、唾液链球菌群、牛链球菌群、咽峡炎链球菌群和缓症链球菌。咽峡炎链球菌群包括A、C、F和G抗原形成小菌落β溶血链球菌。
使用肉汤稀释法测定草绿色链球菌对氯霉素、克林霉素、红霉素、利奈唑胺和四环素时,拖尾生长会造成终点值难以判定,此时可以忽略底部的微弱生长。
使用青霉素或氨苄西林对青霉素中介,或氨苄西林中介的草绿色链球菌进行治疗时,需用一种氨基糖苷类药敏联合用药。
红霉素可以预判克林霉素和地红霉素的敏感性。
使用奥利万星进行治疗时折点基于1200mg静脉输入1次的给药方案。
青霉素与氨基糖苷类及三代头孢对该菌的细胞壁结合位点不同可以协同治疗。
表4:肠球菌
药物分组 药物名称
A组 | 青霉素、氨苄西林 |
B组 | 达托霉素(呼吸道标本不报)、利奈唑胺、万古霉素 |
C组 | 替考拉宁、特拉万星、奥利万星、庆大霉素(仅用于测试高水平耐药菌株)、链霉素(仅用于测试高水平耐药菌株) |
O组 | 环丙沙星、左氧氟沙星、诺氟沙星、呋喃妥因、四环素 |
肠球菌中氨苄西林的敏感性可以预报阿莫西林的敏感性。氨苄西林的结果可以预报不产β-内酰胺酶的肠球菌属对阿莫西林/克拉维酸、氨苄西林/舒巴坦和哌拉西林/他唑巴坦的敏感性。粪肠球菌中氨苄西林的敏感性可以预报对亚胺培南的敏感性。
青霉素敏感的非产β-内酰胺酶的肠球菌,可以预报对氨苄西林、阿莫西林、阿莫西林/克拉维酸、氨苄西林/舒巴坦和哌拉西林/他唑巴坦的敏感性,但是不能反推。
肠球菌属对头孢类、克林霉素类、复方新诺明体外药敏实验显示敏感,但临床治疗往往无效,出具药敏报告时应报耐药。
高水平的氨基糖苷类药物敏感时,预示着可以联合使用针对细胞壁的药物(β-内酰胺类、糖肽类、环脂肽类),加上一种氨基糖苷类药物治疗(引起心内膜炎的肠球菌很难清除,往往使用该方案)。但是一些抗细胞壁的抗生素对肠球菌的效果有限,比如:替卡西林、厄他西林、头孢类和氨曲南,当不能使用氨基糖苷类药物时可使用氨基青霉素联合头孢曲松治疗。
氨苄西林折点基于静脉给药2g q4/q6或阿莫西林1-2g q6胃肠外给药。
口服氨苄西林仅仅用于治疗非复杂性尿路感染时,折点基于氨苄西林口服500mg q6,或阿莫西林口服250mg q8或500mg q12的给药方案。
万古霉素:折点基于1500mg(单剂)或1000mg(双剂,时间超过30min),一周后500mg(给药时间超过30min)
05 耐药性
不同类型的肺炎链球菌对多种抗生素的敏感性存在差异。青霉素G作为传统抗生素,在肺炎链球菌中仍表现出较高的敏感性,但在脑膜炎情况下的敏感性相对较低。头孢类抗生素如头孢曲松、头孢吡肟等在非脑膜炎情况下显示出较高的敏感性,但在脑膜炎时有所下降。美罗培南、左氧氟沙星等新型抗生素则表现出更广泛的抗菌谱和较高的敏感性。
值得注意的是,链球菌对红霉素、克林霉素等抗生素的耐药率有所上升,这可能与抗生素的广泛使用有关。此外,四环素等抗生素的敏感性也相对较低,提示在临床应用中需谨慎选择。
链球菌属对夫西地酸、低水平的氨基糖苷类药物、氨曲南、多黏菌素B天然耐药,其中化脓性链球菌(主要为A群β溶血性链球菌)和无乳链球菌对复方新诺明天然耐药。
肠球菌属对夫西地酸、低水平的氨基糖苷类药物、氨曲南、多黏素B天然耐药,对头孢类、克林霉素类、复方新诺明体外药敏实验显示敏感,但临床治疗往往无效,出具药敏报告时应报耐药。其中粪肠球菌对喹奴普丁-达福普丁天然耐药,鹑鸡肠球菌/酪黄肠球菌对喹奴普丁-达福普丁和万古霉素天然耐药。
06 结语
近年来,随着抗生素的广泛使用,链球菌的耐药性问题日益严峻。例如,肺炎链球菌对青霉素等β-内酰胺类抗生素的耐药率显著增加,给临床治疗带来了巨大挑战。此外,链球菌还可能对其他类别的抗生素如大环内酯类、氟喹诺酮类等产生耐药性。因此,临床上需根据药敏试验结果合理选择抗生素。
元医动物医学诊断实验室
微生物平台项目优势
动物病原微生物二级实验室(ABSL-2)备案
采用全自动MIC药敏分析仪,MIC+KB双方法学开展药敏试验
严格遵循CLSI-2023+CLSI-VET01/08/09国际临床微生物试验标准执行
MALDI-TOF微生物质谱法+16S rRNA基因扩增测序法进行微生物鉴定
比色与比浊联合测定,4波长同时检测,定时不间断自动判读,AI智能算法模型。
多中心联合构建的菌株库、数据库和专家系统,数据库实时更新,结果报告更有保障。
自动修正天然耐药和强制耐药的药敏解释,涵盖ESBLs、CRE、MRSA、VRE、PRSP高水平耐药和诱导耐药等临床耐药表型检测。
需氧/厌氧/兼性厌氧菌、酵母菌、皮肤癣菌、血培养多种培养方式
药敏试验涵盖兽用及人用常见抗生素50+,前沿新药10+
推荐项目

参考文献
[1] Mateu E, Martin M. Why is anti-microbial resistance a veterinary problem as well? J Vet Med B Infect Dis Vet Public Health. 2001 Oct;48(8):569-81.
[2]Clinical and Laboratory Standards Institute. 2018. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically: approved standard. Document M07-A11, Clinical and Laboratory Standards Institute.
[3]Clinical and Laboratory Standards Institute. 2019. Performance standards for antimicrobial susceptibility testing: approved standard. Document M100-S29, Clinical and Laboratory Standards Institute.
[4]周庭银,章强强.临床微生物学诊断与图解(第四版).上海科学技术出版社,2017.
[5]陆承平. (2001).兽医微生物学.中国农业出版社.







